Ozonoterapia frente al COVID-19
mayo 15, 2020Entienda y confíe en la Ozonoterapia
marzo 30, 2020
Perspectivas para el uso de ozono / oxigenoterapia en el tratamiento del nuevo coronavirus (COVID-19), reporte de caso
Durante los primeros veinte años de este milenio, los brotes mundiales graves y bien conocidos de coronavirus (CoV) se han asociado con brotes importantes de enfermedades en el este de Asia y el Medio Oriente. El síndrome respiratorio agudo severo (SARS) y el síndrome respiratorio de Oriente Medio (MERS) comenzaron a surgir en 2002 y 2012 respectivamente.(1,2)
Un nuevo coronavirus que causa el síndrome respiratorio agudo severo, el coronavirus 2 (SARS-CoV-2), surgió a fines de 2019 en China y se propagó rápidamente por todo el país y posteriormente a otros países.(1,2)
Debido a la gravedad de este brote y potencial de propagación a escala internacional, la OMS declaró una emergencia sanitaria mundial el 31 de enero de 2020, posteriormente, el 11 de marzo de 2020, la declaró una situación de pandemia.
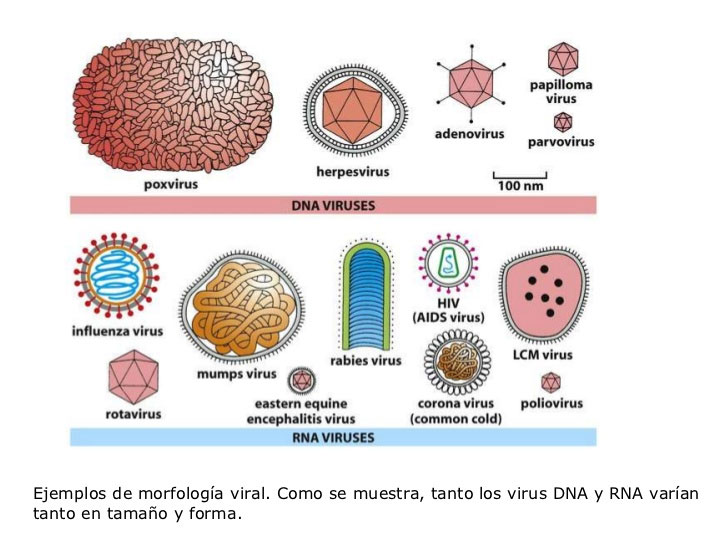
La aparición actual de COVID-19 es el tercer brote de CoV en humanos en las últimas dos décadas.(1,3)
Esta enfermedad infecciosa todavía estaba afectando al mundo, y los precedentes sugirieron que podría no ser el último.
La reciente pandemia mundial de la enfermedad por coronavirus 2019 (COVID-19) causada por el nuevo coronavirus del síndrome respiratorio agudo severo (SARS-CoV-2), ha llamado la atención internacional sobre las infecciones y destaca la importancia de aumentar la comprensión de este patógeno.(4)
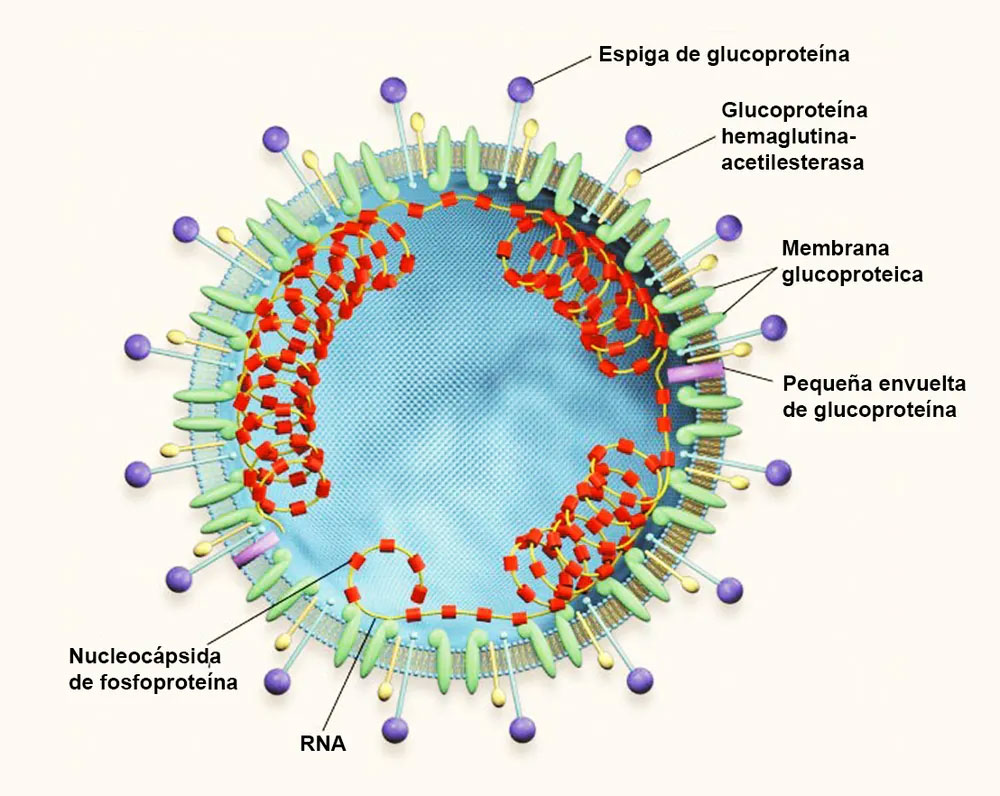
Estructura típica del virión de un coronavirus de tipo 2.
Referencia de imagen: Modificado a partir de K.V. Holmes (N Engl J Med 348:1948-1951; 2003). Luis Monje.
Los coronavirus son virus de ARN monocatenario con envoltura que constan de cuatro subgrupos principales, a saber, alfa, beta, gamma y delta. A menudo provocan infecciones en mamíferos y aves, y en los seres humanos suelen provocar infecciones respiratorias como el resfriado común. Otros coronavirus que afectan a los seres humanos incluyen los alfacoronavirus y los betacoronavirus.(4,5)
El genoma del ARN y la fosfoproteína de la nucleocápside viral forman una nucleocápside helicoidal. Una corona de picos grandes y distintivos en la envoltura permite identificar a los coronavirus por microscopía electrónica. Los picos, oligómeros de la glucoproteína pico (S), se unen a los receptores de las células huésped y fusionan la envoltura viral con las membranas de la célula huésped. Los coronavirus del grupo 2 también tienen una glucoproteína hemaglutinina-acetilesterasa que se une a los restos de glucosa en las membranas celulares.
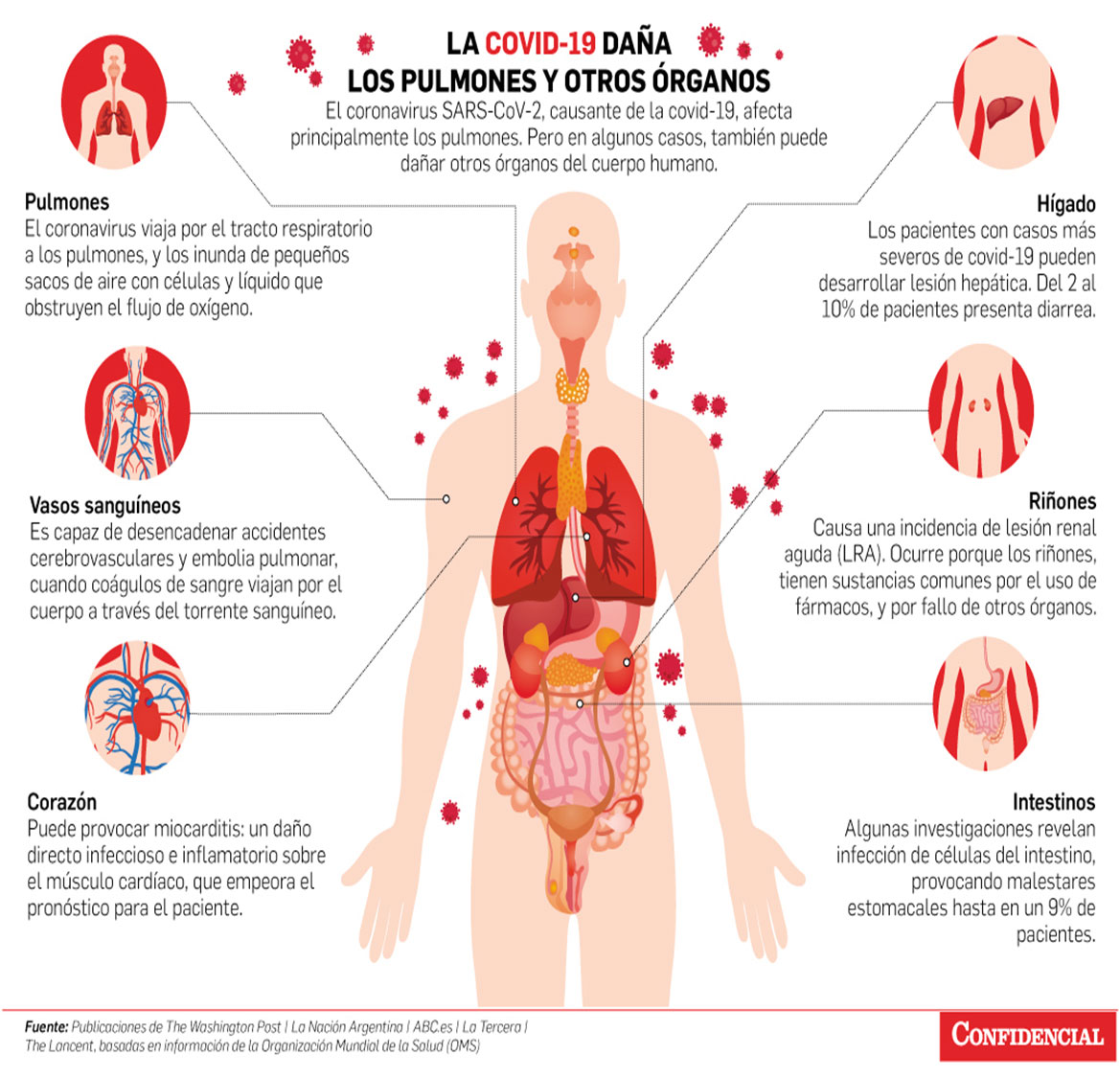
Por ejemplo, el síndrome respiratorio agudo severo (SARS) y el síndrome respiratorio de Oriente Medio (MERS) son causados por betacoronavirus SARS-CoV y MERS-CoV, respectivamente.
Aunque afectan principalmente a los pulmones, estas infecciones pueden tener consecuencias multisistémicas, que incluyen el tracto gastrointestinal, el corazón y los riñones.(6)
Estos virus altamente patógenos (SARS-CoV, MERS-CoV y SARS-CoV-2) causan neumonía atípica en humanos que puede evolucionar a lesión pulmonar aguda (ALI) o síndrome de dificultad respiratoria aguda (SDRA) que conduce a una alta morbilidad y mortalidad. aunque también pueden causar síndromes graves en personas con inmunidad debilitada.(7,8,9)
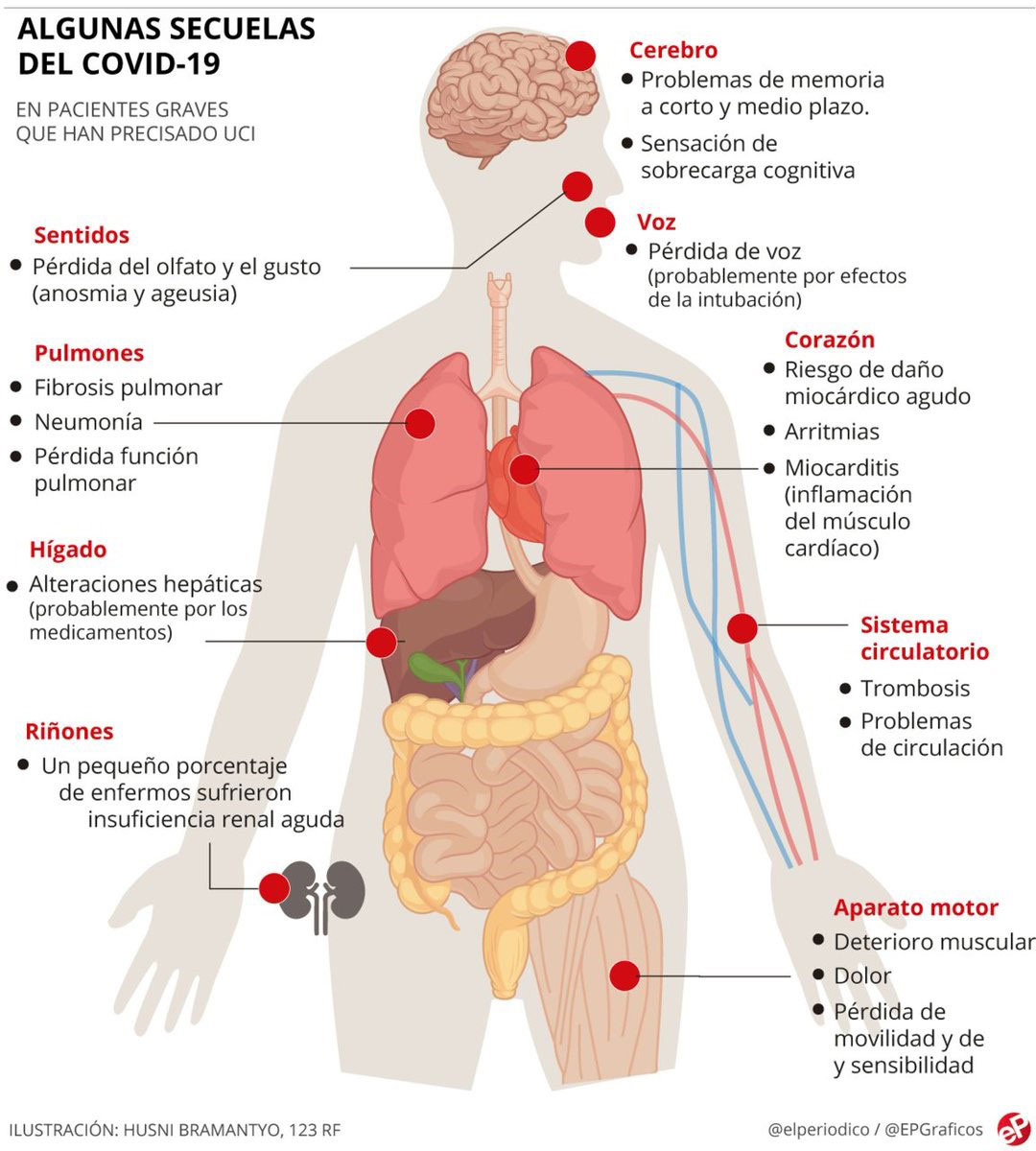
El nuevo COVID-19 causado por el SARS-CoV-2 se parece a otras infecciones por betacoronavirus como el SARS y el MERS en muchos aspectos, por lo que la infección desencadena una respuesta inflamatoria sistémica.
Además, las infecciones graves por coronavirus a menudo demuestran una afectación multiorgánica, lo que tiene implicaciones en la manifestación clínica, la transmisión y el pronóstico de la enfermedad.
En el síndrome respiratorio agudo severo, el síndrome respiratorio de Oriente Medio y la enfermedad por coronavirus 2019, las comorbilidades como la hipertensión, la diabetes mellitus y las cardiopatías se relacionan con el ingreso en la unidad de cuidados intensivos, la ventilación mecánica y la mortalidad.(4,7)
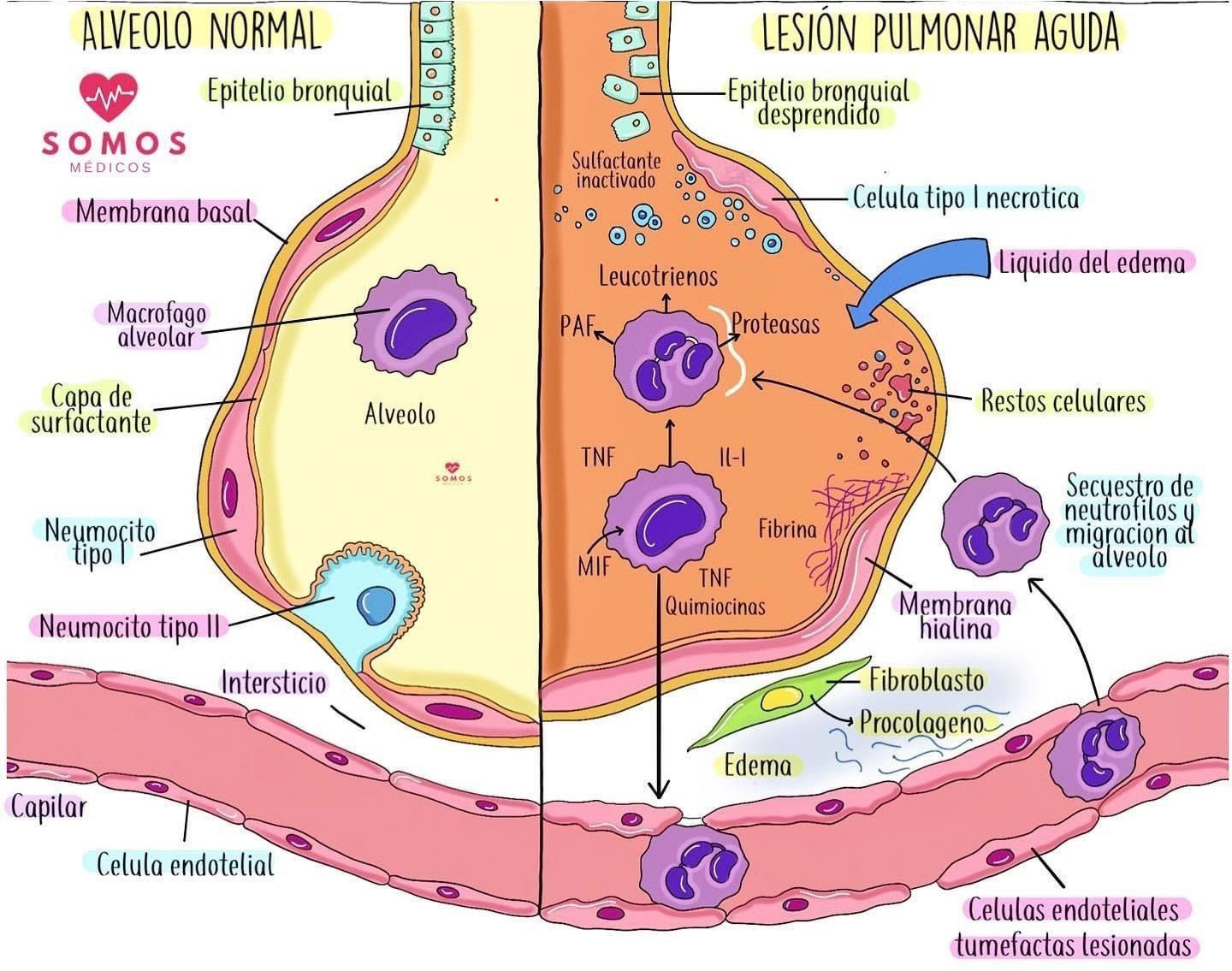
Los coronavirus infectan predominantemente las vías respiratorias inferiores (bronquios terminales y alvéolos pulmonares) y causan neumonía mortal que puede resultar en lesión pulmonar aguda (ALI) o síndrome de dificultad respiratoria aguda (SDRA) con alta mortalidad.(4,7)
SDRA, una causa principal de La insuficiencia respiratoria se caracteriza teóricamente por un deterioro severo del intercambio de gases que eventualmente puede conducir a hipoxemia progresiva severa, disnea y excreción de dióxido de carbono deficiente.(4,7,10)
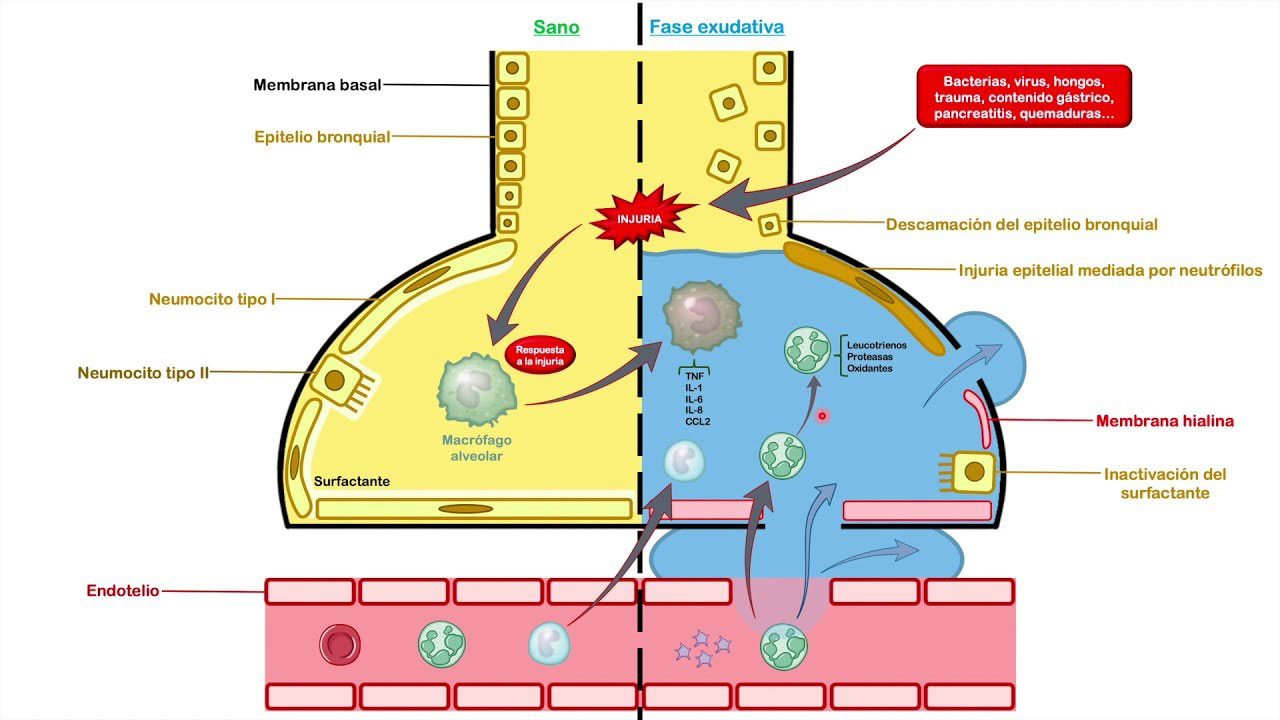
SDRA: Síndrome de Dificultad Respiratoria Aguda Definición, Fisiopatología y Diagnóstico, por: Dr.Baelish, 2 nov 2020
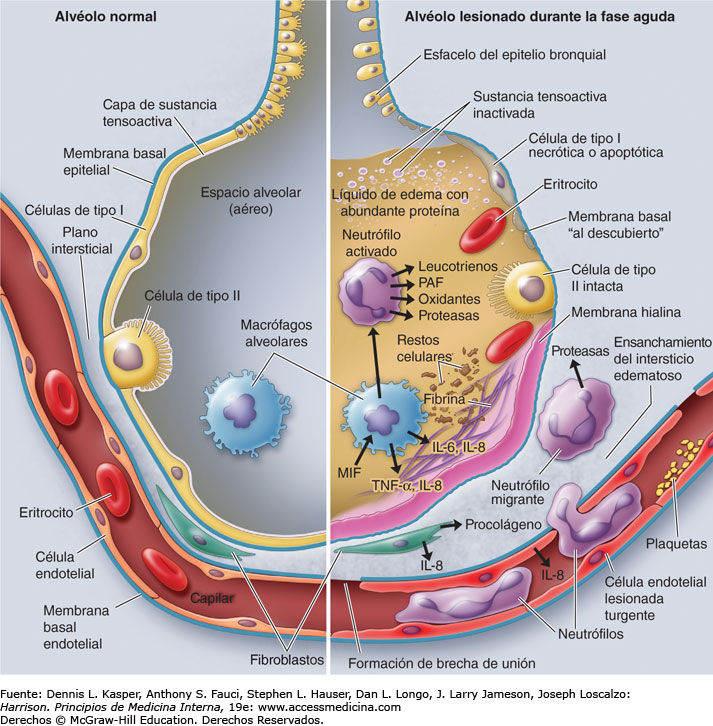
El daño alveolar difuso (DAD), un sello patológico característico de la fase aguda del SDRA, se divide aproximadamente en dos fases: la fase aguda con formación de membrana hialina, inflamación intersticial aguda y edema y la fase organizativa con fibrosis poco organizada y tipo II hiperplasia de neumocitos.(4,7,11)
En pacientes infectados con COVID-19, además, la hiperemia vascular del tabique alveolar, el edema y la trombosis transparente intravascular indican la lesión de las células endoteliales pulmonares.(4,7,12)
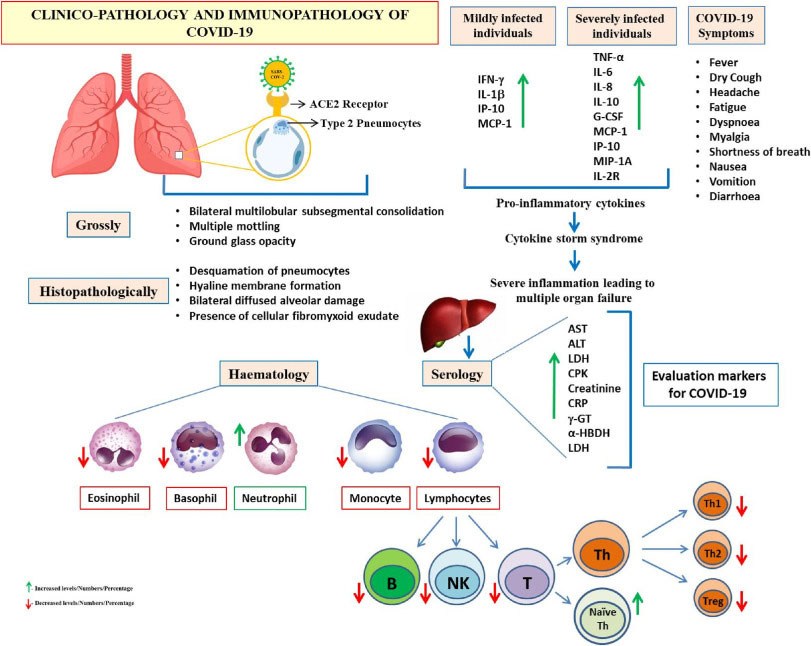
Referencia de imagen: An update on SARS-CoV-2/COVID-19 with particular reference to its clinical pathology, pathogenesis, immunopathology and mitigation strategies. KuldeepDhama, Shailesh KumarPatel, MamtaPathak, Mohd IqbalYatoo, RuchiTiwari, Yashpal SinghMalik, RajendraSingh, RanjitSah, Ali A.Rabaan, D. Katterine Bonilla-Aldana, Alfonso J.Rodriguez-Morales. Travel Medicine and Infectious Disease, Volume 37, September–October 2020, 101755.
Las características de laboratorio del SARS y el MERS fueron varios grados de pancitopenia, incluidas linfopenia y trombocitopenia.(7,13,14)
Se informó que los niveles séricos de
lactato deshidrogenasa (LDH),
alanina aminotransferasa (ALT),
aspartato aminotransferasa (AST)
y creatina quinasa (CK) están elevados en pacientes con SARS y MERS fatales.(7,14,15,16,17)
Al igual que el SARS y el MERS, los análisis de sangre de rutina mostraron linfopenia en el 35% de los casos infectados por el SARS-CoV-2. ALT, AST y LDH aumentaron en 28% a 76% de los pacientes.
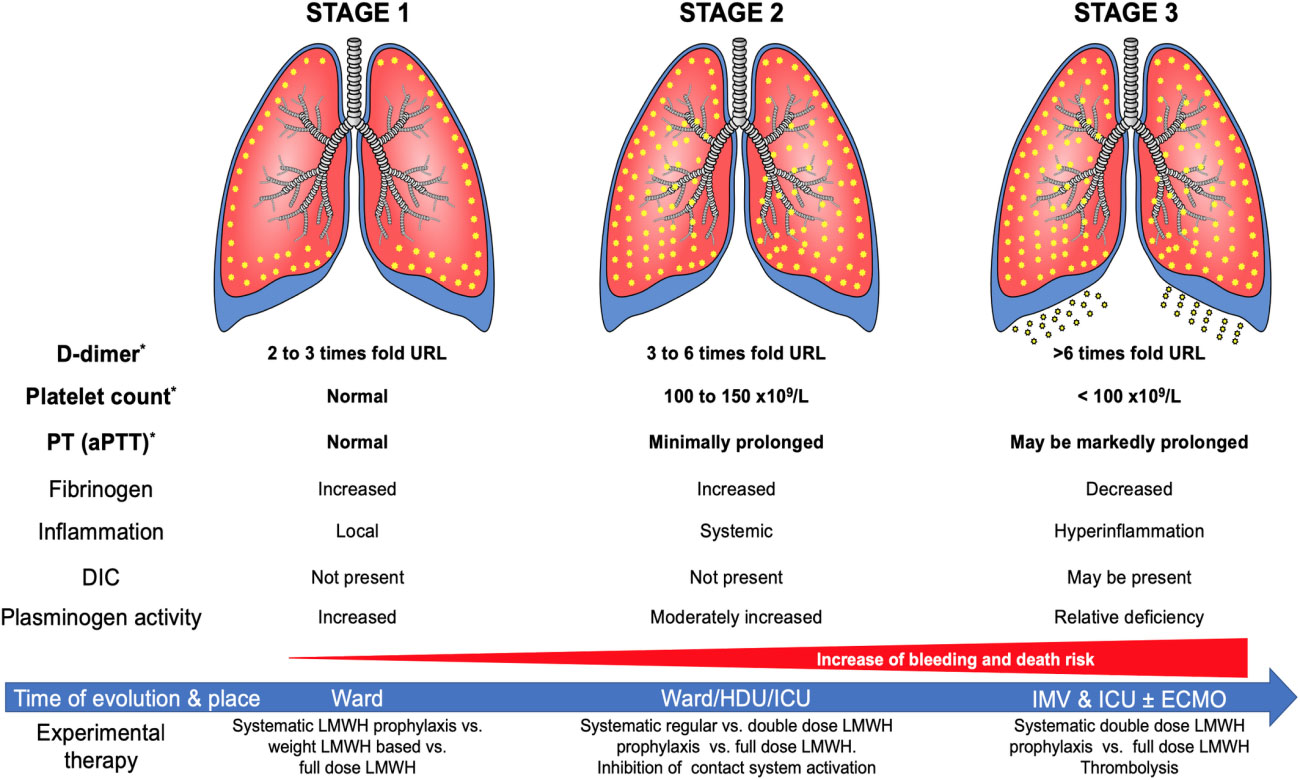
Etapas de la enfermedad por coronavirus 2019 (COVID-19): anomalías hemostáticas asociadas.
Referencia de imagen: Coronavirus Disease 2019–Associated Thrombosis and Coagulopathy: Review of the Pathophysiological Characteristics and Implications for Antithrombotic Management. Luis Ortega-Paz ,Davide Capodanno , Gilles Montalescot ,Dominick J. Angiolillo. J Am Heart Assoc. 2021;10:e019650.
En los casos graves de infección por SARS-CoV-2, el nivel de dímero D se elevó notablemente y los linfocitos mostraron una reducción progresiva. (7)
Se estima que 63% de los pacientes con COVID-19 tenían niveles de ferritina sérica por encima del rango normal. (7,9,18)
La comparación entre los pacientes con neumonía por COVID-19 y sin COVID-19 sugirió un impacto de la infección por SARS-CoV-2 en el recuento del subconjunto de linfocitos; el subconjunto de linfocitos B exhibe la disminución más significativa en comparación con la neumonía sin SARS-CoV-2.( 19)
Parámetros de laboratorio incluidos en el COVID-19-asociado etapas de anomalía hemostática descritas.
Abreviaturas:
PTT indica tiempo de tromboplastina parcial activada;
CID, coagulación intravascular diseminada;
ECMO, oxigenación por membrana extracorpórea;
HDU, unidad de alta dependencia;
Unidad de cuidados intensivos;
IMV, ventilación mecánica invasiva;
HBPM: heparina de bajo peso molecular;
PT: tiempo de protrombina;
URL, nivel de referencia superior.
Referencia: Thachil J, Cushman M, Srivastava A. A proposal for staging COVID‐19 coagulopathy. Res Pract Thromb Haemost. 2020; 4:731–736.
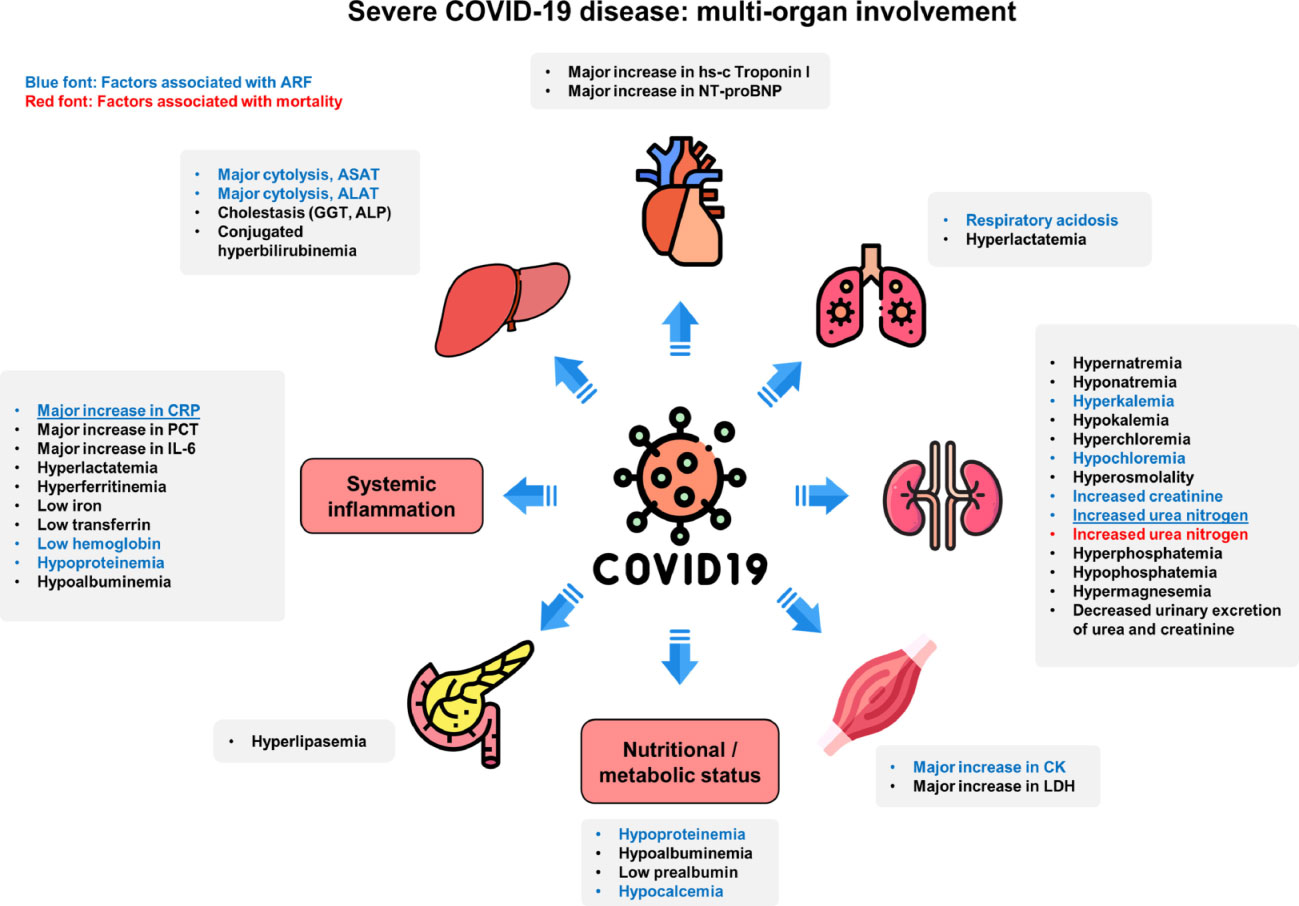
Referencia de imagen: The spectrum of biochemical alterations associated with organ dysfunction and inflammatory status and their association with disease outcomes in severe COVID-19: A longitudinal cohort and time-series design study. Abderrahim Oussalah, Stanislas Gleye, Isabelle Clerc Urmes, Elodie Laugel, Françoise Barbé, Sophie Orlowski, Catherine Malaplate, Isabelle Aimone-Gastin, Beatrice Maatem Caillierez, Marc Merten, Elise Jeannesson, Raphaël Kormann, Jean-Luc Olivier, Rosa-Maria Rodriguez-Guéant, Farès Namour, Sybille Bevilacqua, Nathalie Thilly, Marie-Reine Losser, Antoine Kimmoun, Luc Frimat, Bruno Levy, Sébastien Gibot, Evelyne Schvoerer, Jean-Louis Guéant. EClinicalMedicine ,Published by The Lancet, VOLUME 27, 100554, OCT, 2020
Resumen de la evolución de las principales anomalías bioquímicas y potenciales predictores de insuficiencia respiratoria aguda (IRA) o mortalidad hospitalaria en pacientes con COVID-19 grave.
Los predictores de IRA en análisis bivariados están resaltados en fuente azul.
Los predictores de la mortalidad relacionada con COVID-19 en los análisis bivariados están resaltados en rojo.
Se subrayan los predictores independientes de IRA en el análisis multinivel multivariable.
Abreviaturas:
ALP: fosfatasa alcalina;
ASAT: aspartato aminotransferasas;
ALAT: alanina aminotransferasas;
CK: creatina quinasa;
CRP: proteína C reactiva;
GGT: γ-glutamiltransferasa;
Troponina l hs-c: troponina I cardíaca de alta sensibilidad;
IL-6: interleucina 6;
LDH: lactato deshidrogenasa;
NT-pro-BNP: péptido natriurético pro-cerebral N-terminal;
PCT: procalcitonina
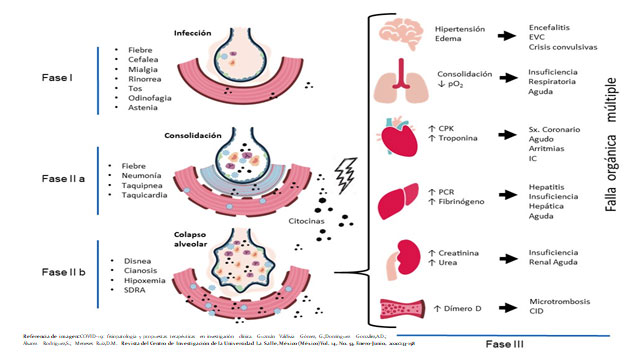
Referencia de imagen: COVID-19: fisiopatología y propuestas terapéuticas en investigación clínica. Guzmán Valdivia Gómez, G.;Domínguez González,A.D.;Álvarez Rodríguez,S.; Meneses Ruiz,D.M. Revista del Centro de Investigación de la Universidad La Salle, México (México)Vol. 14, No. 53, Enero-Junio, 2020:133-158
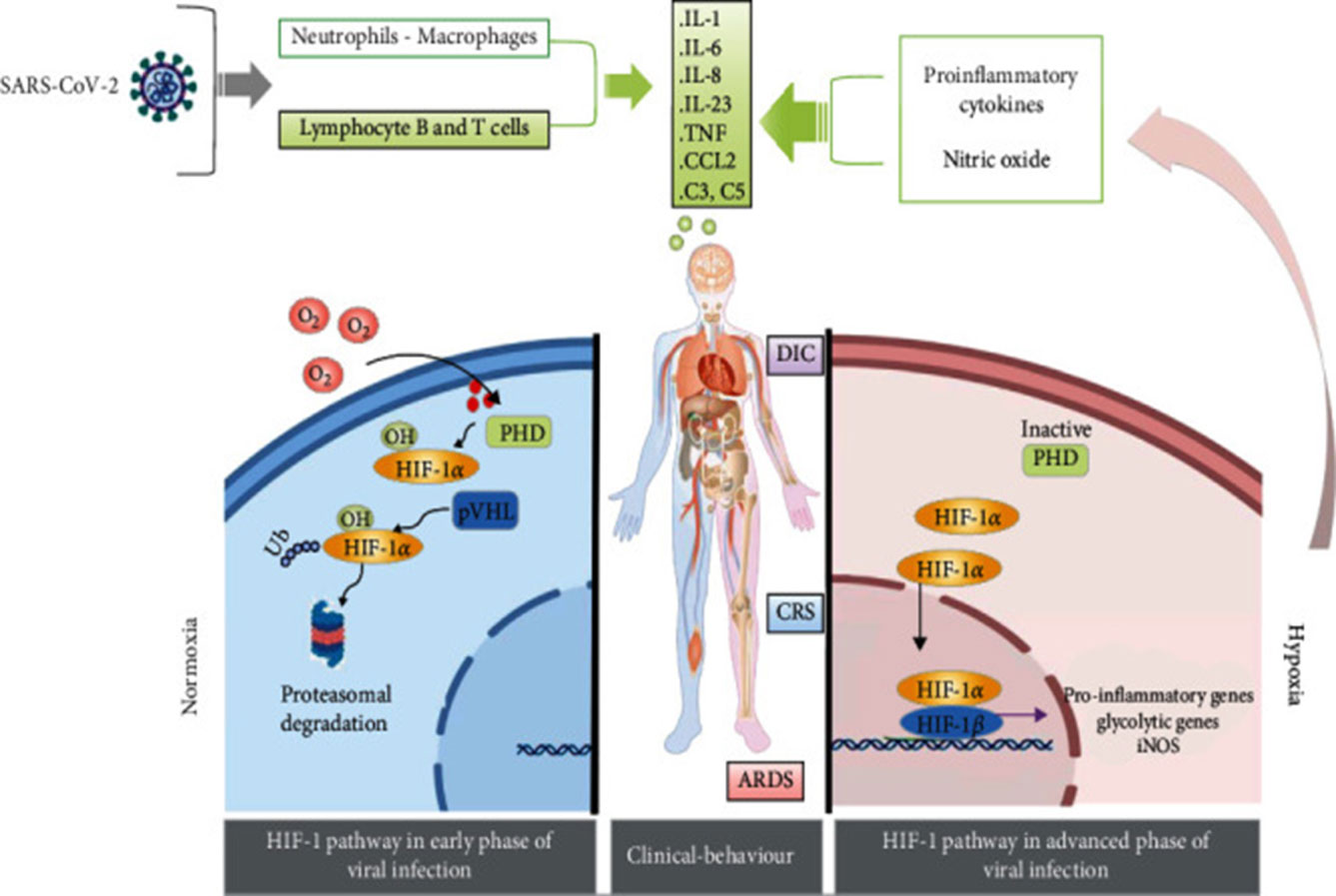
Síndrome de SARS-CoV-2 severo como resultado de la hipoxia y la activación de la vía de señalización HIF-1.
Referencia de imagen: HIF-1, the Warburg Effect, and Macrophage/Microglia Polarization Potential Role in COVID-19 Pathogenesis. Elisabetta Ferraro, Maria Germanò, Rocco Mollace, Vincenzo Mollace, Natalia Malara. Oxidative Medicine and Cellular Longevity, 2021, 8841911, 10.
De hecho, la hipoxia altera la fisiología y la función de las células B, lo que conduce a una proliferación reducida y una mayor muerte de las células B. Los niveles reducidos de linfocitos B en pacientes con SARS-CoV-2 podrían estar asociados con la activación del factor 1 inducible por hipoxia (HIF-1).(20)
Además, la hipoxia y la activación constitutiva (HIF-1) impiden la generación de alta -anticuerpos IgG de afinidad.(21) y HIF-1α modula la variación del isotipo de Ig recombinante en las células B, lo que influye en el recuerdo de la memoria. Por lo tanto, la producción disfuncional de anticuerpos que se produce en COVID-19 posiblemente esté relacionada con el daño hipóxico de las células B.(22)
Abreviaturas:
SDRA: síndrome de dificultad respiratoria aguda;
CCL: ligando de quimiocina (motivo C-C);
CRS: síndrome de liberación de citocinas;
CID: coagulación intravascular diseminada;
HIF-1: factor inducible por hipoxia;IL: interleucina;
iNOS: NO sintasa inducible;
pVHL: supresor de tumores de von Hippel-Lindau;
SARS-CoV-2: coronavirus del síndrome respiratorio agudo severo;
TNF: factor de necrosis tumoral.
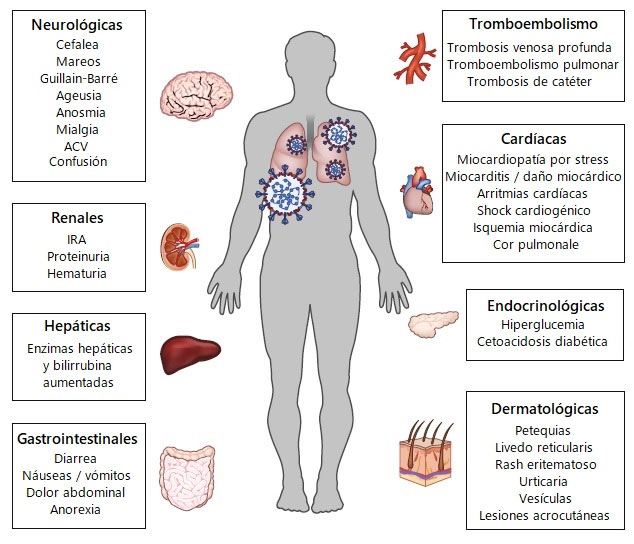
Estas características de laboratorio indican que las infecciones fatales por coronavirus provocan daños en múltiples órganos, incluidos los sistemas hematológico, hepático y renal.(7)
La gravedad clínica del síndrome respiratorio agudo severo (SARS-CoV-2) está determinada por la respuesta multivariante al virus, y la hipoxia juega un papel importante en la patogénesis de la reacción inmune desadaptativa contra el Coronavirus 2 (SARS-CoV-2).(19)
Una característica de COVID-19 es la hipoxia tisular junto con la sobre expresión del factor inducible por hipoxia-1 (HIF-1) junto con sus consecuencias de respuesta inmunometabólica e inmunitaria.
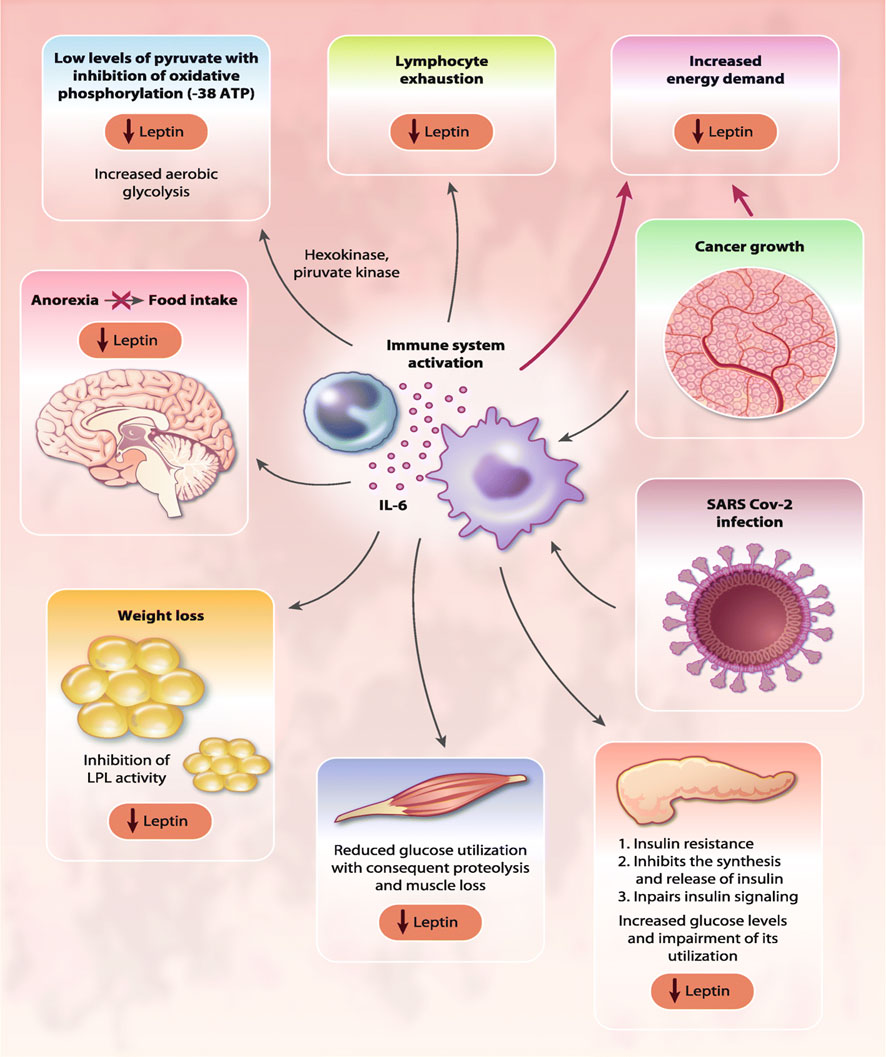
Efectos sistémicos de IL-6 en cáncer y COVID-19.
Referencia de imagen: COVID-19 and cytokine storm syndrome: can what we know about interleukin-6 in ovarian cancer be applied?. Antonio Macciò,Sara Oppi, Clelia Madeddu. Journal of Ovarian Research 14: 28 (2021)
El comportamiento clínico heterogéneo y severo del COVID-19 multiorgánico en función de la expresión regulada por hipoxia y la reprogramación metabólica se asocia con una respuesta inmune proinflamatoria inherente.
El estado de la infección, junto con una disfunción respiratoria grave, provoca una falta de oxígeno en los tejidos debido a la diferencia entre la cantidad de oxígeno absorbido por la célula y su consumo similar al observado en el tejido tumoral durante el desarrollo de múltiples cánceres sólidos.(19)
La IL-6 ejerce efectos sistémicos sobre el metabolismo energético, incluida la inducción de resistencia a la insulina de los músculos periféricos y el deterioro de la señalización de la insulina, que se asocian con un aumento de la oxidación de aminoácidos, el balance energético negativo y la proteólisis muscular.(23)
Abreviaturas:
IL, interleucina;
LPL, lipoproteína-lipasa
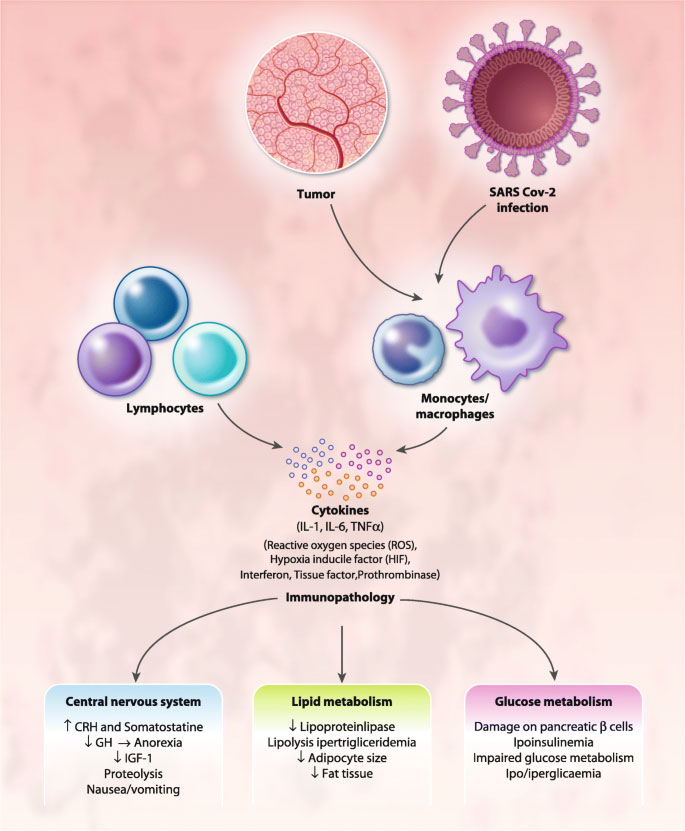
Mecanismos de inmunopatología en cáncer y COVID19.
Referencia de imagen: COVID-19 and cytokine storm syndrome: can what we know about interleukin-6 in ovarian cancer be applied?. Antonio Macciò,Sara Oppi, Clelia Madeddu. Journal of Ovarian Research 14: 28 (2021)
Tanto en el cáncer como en los macrófagos activados y / o infectados por COVID-19 inducen una respuesta inflamatoria con producción prolongada y excesiva de citocinas proinflamatorias, interferón, especies reactivas de oxígeno y factores procoagulantes que provocan cambios inmunopatológicos, lo que conduce a síntomas asociados con la conducta de enfermedad. incluyendo anorexia y cambios específicos en el metabolismo energético.(23)
Abreviaturas:
IL, interleucina;
TNF, factor de necrosis tumoral;
CRH, hormona liberadora de corticotropina;
GH, hormona del crecimiento;
IGF, factor de crecimiento de insulina
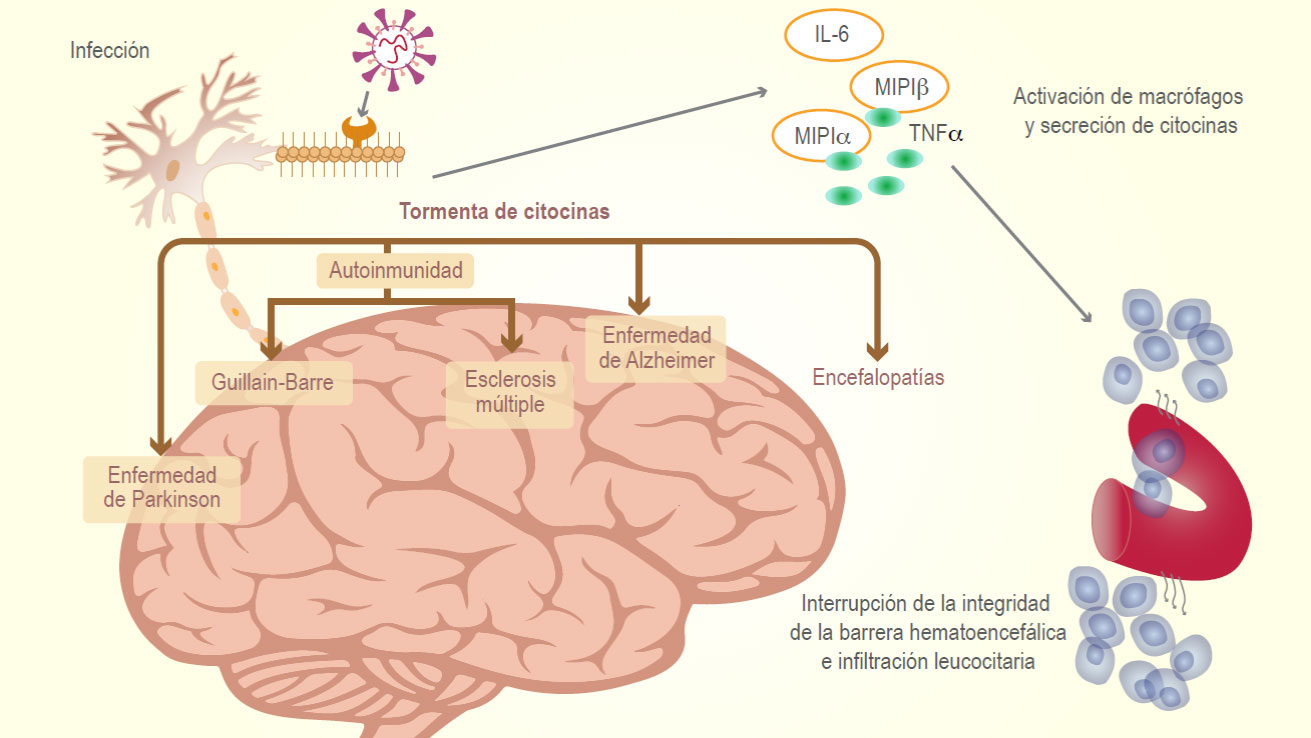
La neurología de COVID-19.
Referencia de imagen: The neurology of COVID-19 .Carlos Cuevas-García, Alejandra Calderón-Vallejo, Laura Berrón-Ruiz. Revista Alergia México. 2020;67(4):338-349.
El virus SARS-CoV-2 afecta los pulmones y los vasos sanguíneos y también el SNC donde induce principalmente una respuesta inflamatoria crónica y pronunciada y una tormenta de citocinas que daña indirectamente el SNC.(24)
También se deben los síntomas neurológicos de la infección por COVID-19 , a la respuesta inmune sistémica masiva y las citocinas proinflamatorias subsiguientes y la infiltración de linfocitos T citotóxicos en el SNC.
Los mecanismos patológicos de la participación del SNC mediada por el sistema inmunitario en la infección por SARS-CoV-2.
Después de la infección de SARS-CoV-2 en el SNC, se activan los macrófagos con liberación extrema de citocina y quimiocinas e infiltración de linfocitos en el SNC, por lo tanto se manifiestan diversos trastornos neurológicos.(25)
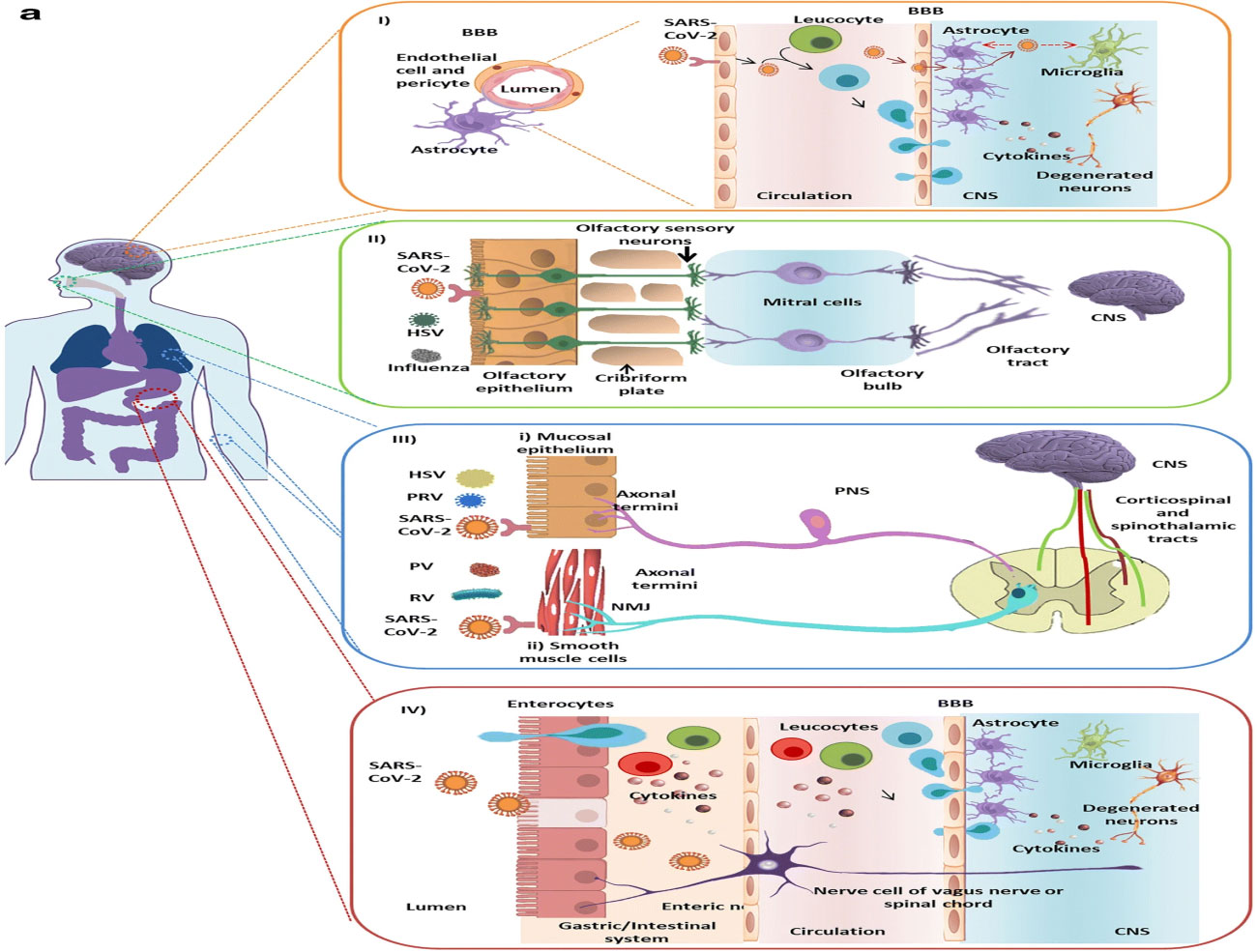
Vías de entrada de virus al sistema nervioso central (SNC).
Referencia de imagen: SARS-CoV-2, an Underestimated Pathogen of the Nervous System. Shweta Jakhmola, Omkar Indari, Sayantani Chatterjee & Hem Chandra Jha. SN Comprehensive Clinical Medicine volume 2, pages2137–2146 (2020)
El virus en el torrente sanguíneo puede infectar las células inmunitarias periféricas. Estos leucocitos infectados pueden atravesar la barrera hematoencefálica (BHE) compuesta por uniones estrechas especializadas, células endoteliales, pericitos y astrocitos. (I)
Además, el virus también puede atravesar la BHE que podría cortarse debido a la acción de las citocinas o puede entrar en el líquido cefalorraquídeo (LCR) por interacción directa con las células del endotelio microvascular del cerebro.
Ambos mecanismos provocan alteraciones en la homeostasis cerebral y agravan la producción de citocinas en el SNC.(II),(26)
La activación excesiva de la microglía proinflamatoria (MG) parece ser la principal causa de daño neuropatológico en pacientes con COVID-19.
Además, la activación de la vía glucolítica podría causar acidosis en el cerebro que puede contribuir a las manifestaciones neuropatológicas del COVID-19, lo que podría explicar por qué los ancianos tienen un mayor riesgo de sufrir discapacidades neurológicas y cognitivas en el COVID-19.(27,28)
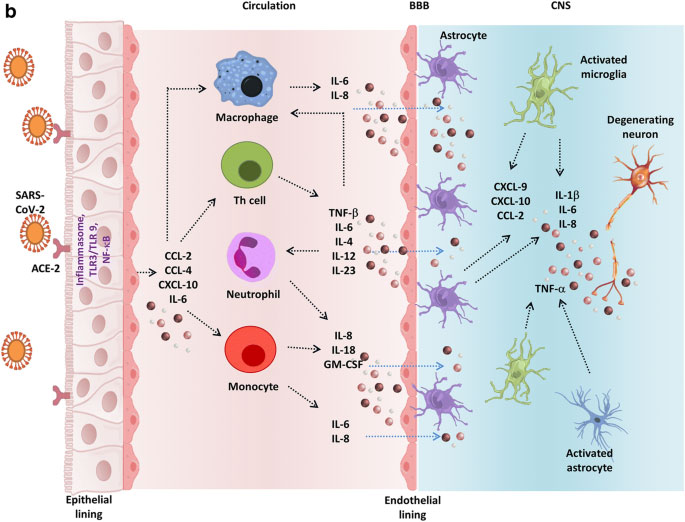
Referencia de imagen: SARS-CoV-2, an Underestimated Pathogen of the Nervous System. Shweta Jakhmola, Omkar Indari, Sayantani Chatterjee & Hem Chandra Jha. SN Comprehensive Clinical Medicine volume 2, pages2137–2146 (2020)
Tormenta de citocinas mediada por SARS-CoV-2. Después de la unión y entrada en las células epiteliales a través del receptor ACE-2, el virus puede activar la vía proinflamatoria a través de la señalización de TLR o NF-κB seguida de la formación de inflamasoma.(26)
Varias citocinas proinflamatorias y quimiocinas liberadas debido a este mecanismo de defensa intrínseco autónomo incluyen CCL-2, CCL-4, CXCL-10 e IL-6.
Estas proteínas atraen varias células inmunes en la circulación como los monocitos, macrófagos, células T y neutrófilos en el sitio de la infección.(26)
Además, la situación empeora por la producción de TNF-β, IL-6, IL-4, IL-12 e IL-23 por parte de los linfocitos T, que acumulan aún más las células inmunes estableciendo un circuito de retroalimentación proinflamatorio.
Estas citocinas pueden dañar la BHE y activar los astrocitos y la microglía, las células inmunitarias residentes en el SNC.
En respuesta, la microglía activada y los astrocitos producen IL-1β, IL-6, TNF-α e IL-8. Los niveles elevados de estas citocinas inflamatorias pueden impartir efectos neurotóxicos que conducen a una disfunción neuronal y diversas patologías asociadas a la enfermedad del SNC.(26)
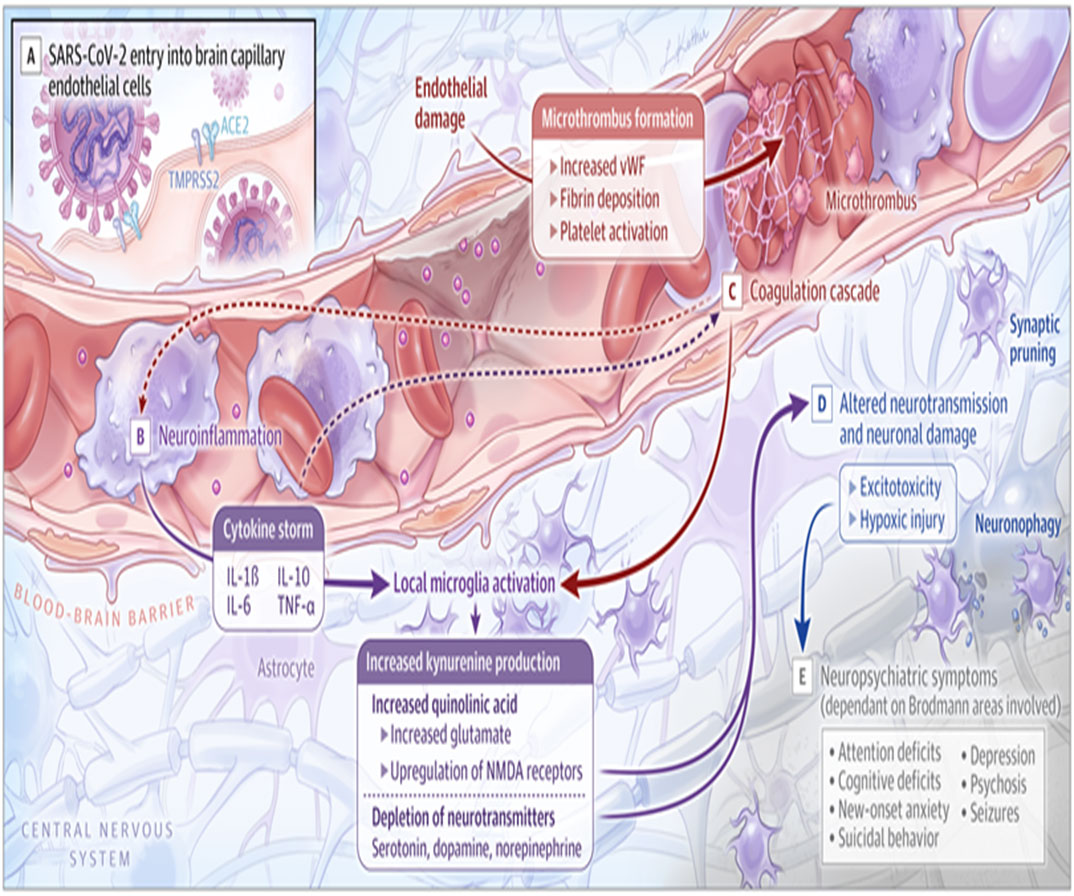
Lesión vascular cerebral, disfunción del sistema neurotransmisor, eventos trombóticos, daño neuronal y síntomas neuropsiquiátricos
Referencia de imagen: How COVID-19 Affects the Brain. Maura Boldrini, Peter D. Canoll, Robyn S. Klein. JAMA Psychiatry, 2021;78(6):682-683
La falta de O2 causada por células epiteliales pulmonares dañadas puede causar en pacientes críticos con COVID-19 trastornos de hipoxia en todo el cuerpo, incluido el SNC, y daño cerebral subsiguiente.(29)
La infección por COVID-19 induce graves condiciones de hipoxia. La hipoxia, a su vez, es el inductor clásico de HIF-1 con la consiguiente producción de citocinas inflamatorias y aumento de la glucólisis. Por lo tanto, la hipoxia podría considerarse patógena para COVID-19 y también para las complicaciones en tejidos sensibles al grado de oxigenación tisular, como en el cerebro, que se encuentra en las formas graves de COVID-19.(30)
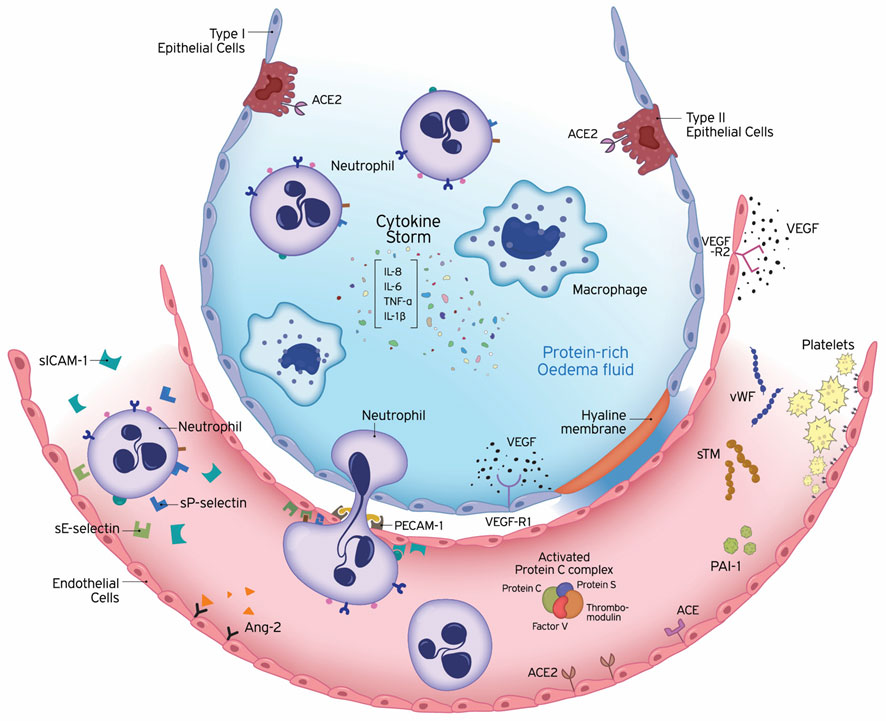
Referencia de imagen: Endothelial Damage in Acute Respiratory Distress Syndrome. Alice G. Vassiliou ,Anastasia Kotanidou, Ioanna Dimopoulou, Stylianos E. Orfanos. Int. J. Mol. Sci. 2020, 21(22), 8793.
En COVID-19, además del daño alveolar, el ataque viral involucra el endotelio y causa coagulación. Los datos de la autopsia han confirmado que la lesión del parénquima pulmonar se caracteriza por engrosamiento de la pared alveolar, hiperpermeabilidad vascular e infiltración de células inflamatorias.(31)
También se describieron embolia pulmonar y trombosis profunda en el plexo venoso debido a trombos de fibrina asociados con niveles altos de (D-dímeros) en la sangre que configuran la coagulación intravascular diseminada (CID).(31)
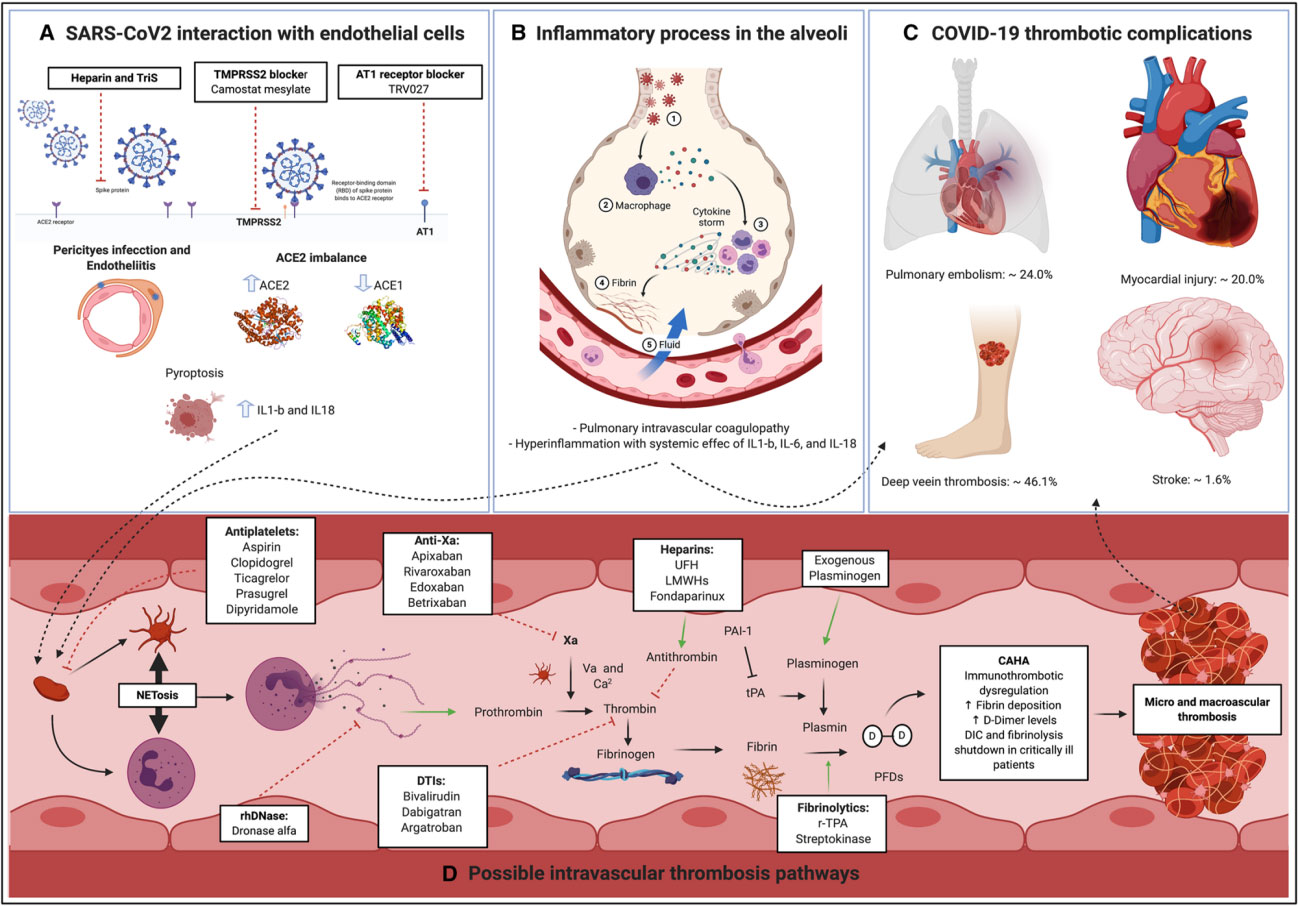
Mecanismo fisiopatológico relacionado con la enfermedad por coronavirus 2019 (COVID-19): trombosis y coagulopatía
Referencia de imagen: Coronavirus Disease 2019–Associated Thrombosis and Coagulopathy: Review of the Pathophysiological Characteristics and Implications for Antithrombotic Management. Luis Ortega-Paz ,Davide Capodanno , Gilles Montalescot ,Dominick J. Angiolillo. J Am Heart Assoc. 2021;10:e019650.
Los microtrombos se identificaron predominantemente en las áreas de alteración alveolar difusa y se relacionaron con daño endotelial difuso, lo que ayuda a explicar la hipoxemia grave que caracteriza al síndrome de dificultad respiratoria aguda (SDRA) en pacientes con COVID-19.(32,33)
El microambiente hipóxico es una condición fisiopatológica generada durante la infección por SARS-CoV-2 que recuerda la que ocurre en la enfermedad del cáncer. La hipoxia surge en el tejido canceroso a través de la proliferación rápida e incontrolada de células cancerosas; la falta paralela de vascularización suficiente lleva a las células cancerosas a consumir rápidamente O2 y nutrientes y a crear un microambiente hipóxico.(34)
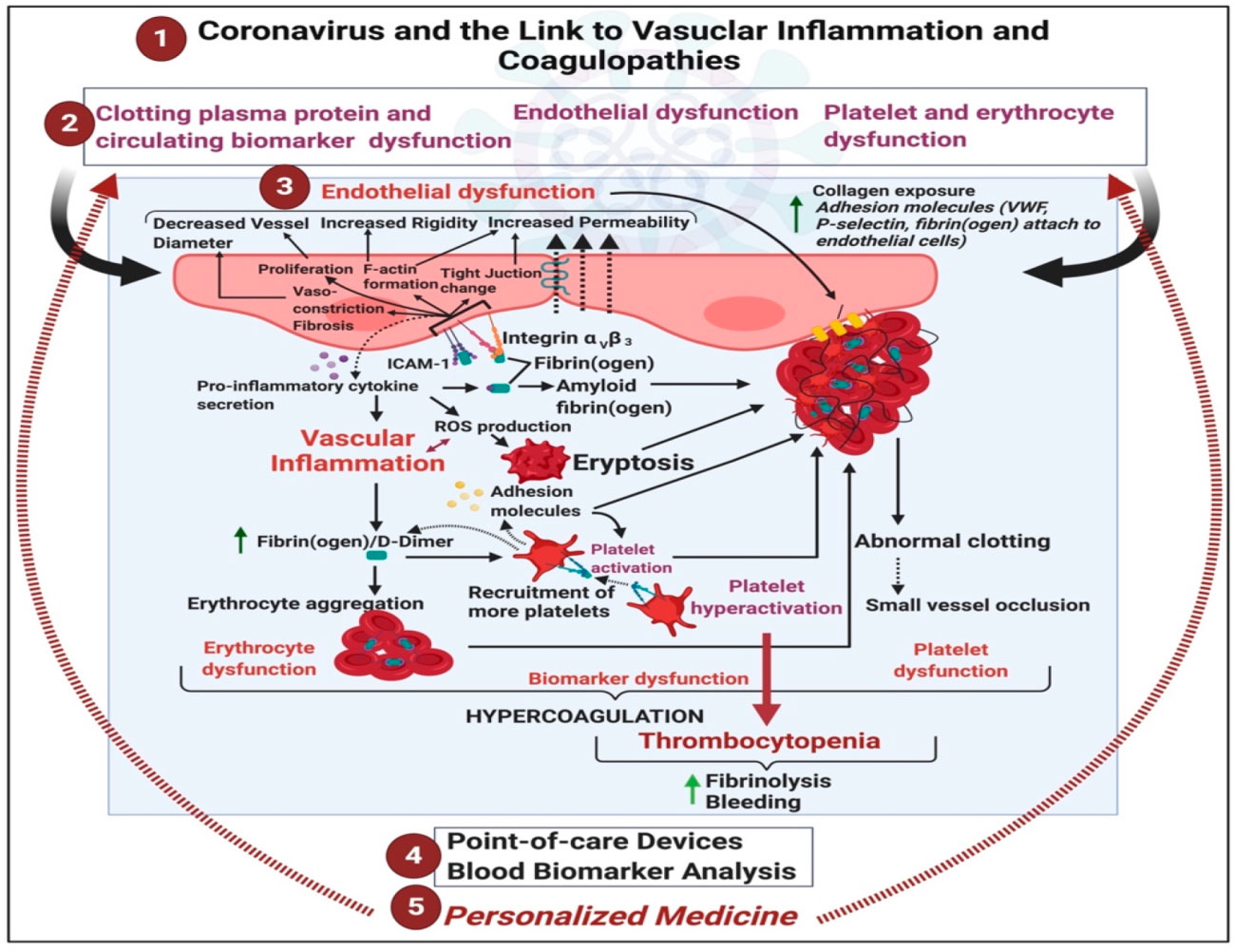
Referencia de imagen: Covid-19: The Rollercoaster of Fibrin(Ogen), D-Dimer, Von Willebrand Factor, P-Selectin and Their Interactions with Endothelial Cells, Platelets and Erythrocytes. Corlia Grobler,Siphosethu C. Maphumulo,L. Mireille Grobbelaar,Jhade C. Bredenkamp,Gert J. Laubscher,Petrus J. Lourens,Janami Steenkamp,Douglas B. Kell, Etheresia Pretorius.Int. J. Mol. Sci. 2020, 21(14), 5168.
(1) Las implicaciones vasculares del síndrome respiratorio agudo coronavirus 2 (COVID-19).
(2) pueden resultar en proteínas de coagulación y biomarcadores circulantes, disfunciones endoteliales y eritrocitarias y plaquetarias.
(3) varios procesos bioquímicos asociados con la disfunción vascular, centrándose en la fibrina (ogen), el dímero D, la selectina P y el factor von Willebrand.
(4) observar los dispositivos y las metodologías en el punto de atención en el tratamiento de COVID-19.(35)
Patología típica en hemorragia y coagulación: el acto de equilibrio entre hemorragia y trombocitopenia e hipercoagulación
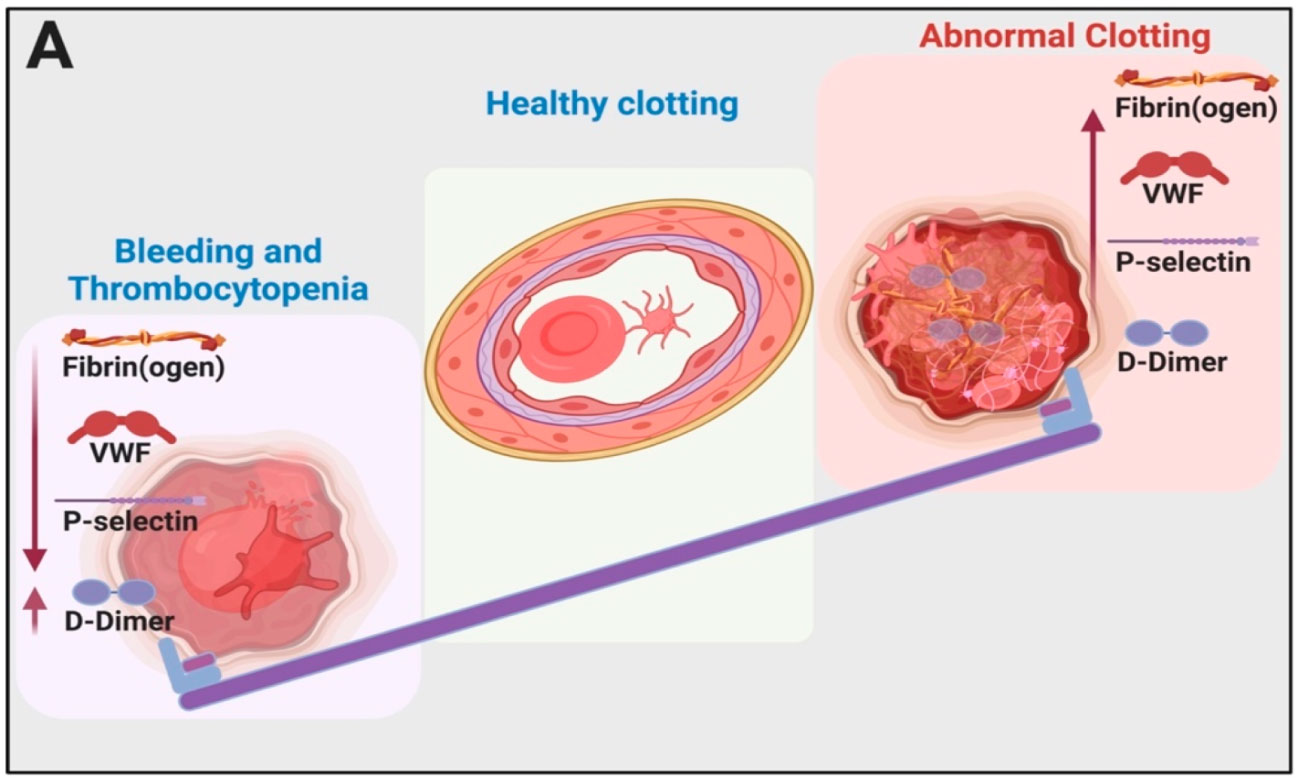
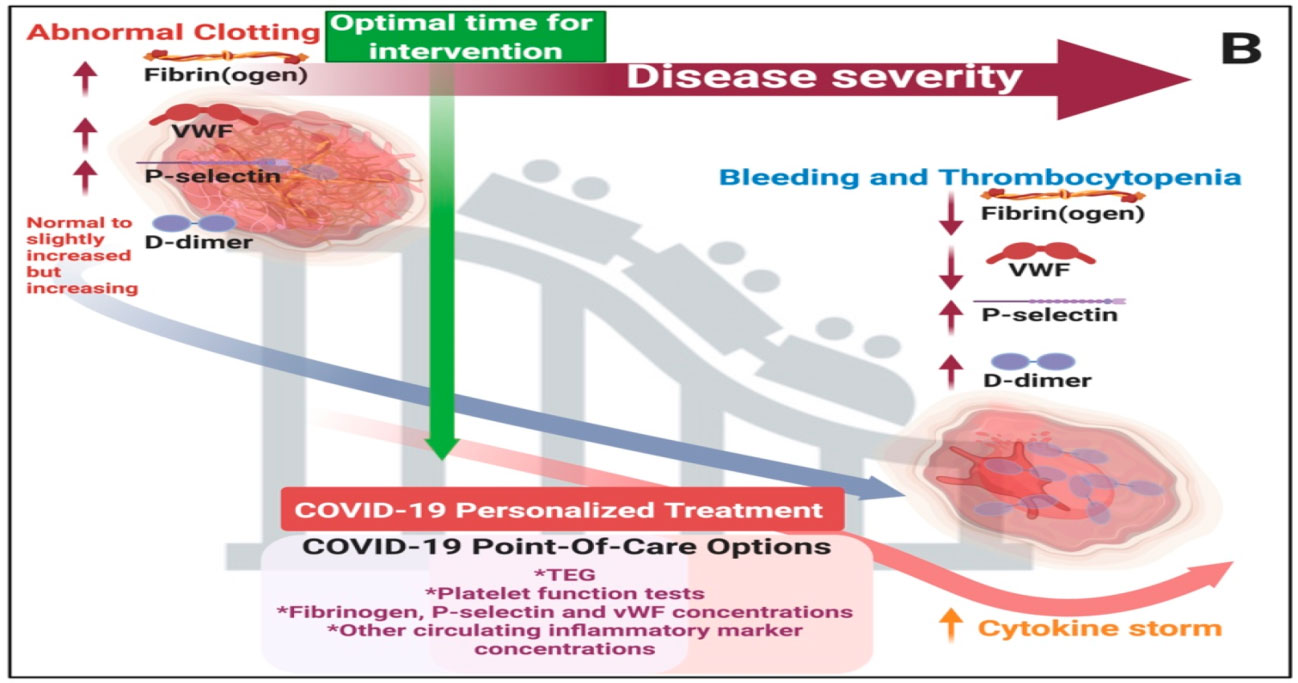
Referencia de imagen: Covid-19: The Rollercoaster of Fibrin(Ogen), D-Dimer, Von Willebrand Factor, P-Selectin and Their Interactions with Endothelial Cells, Platelets and Erythrocytes. Corlia Grobler,Siphosethu C. Maphumulo,L. Mireille Grobbelaar,Jhade C. Bredenkamp,Gert J. Laubscher,Petrus J. Lourens,Janami Steenkamp,Douglas B. Kell, Etheresia Pretorius. Int. J. Mol. Sci. 2020, 21(14), 5168.
Manifestación clínica de hipercoagulación, trombocitopenia y sangrado durante COVID-19, así como opciones de atención clínica y tiempo óptimo para la intervención: durante las primeras etapas de la coagulación anormal, los niveles de dímero D son normales o están ligeramente aumentados, pero aumentarán rápidamente con la progresión de la enfermedad. (Observacion clinica).(35)
__________________________________________________________________________________
Juan Carlos Pérez Olmedo 1, Reza.Akbarzadeh 2 , Reyhaneh.Akbar Zadeh ( Sandra.A Zadeh) 2.
1 – Director Médico en Ozonoterapia Salud, Pontevedra, España.
2 – CentroMedico Avance BioMed, Departamento de Investigación y Desarrollo, Madrid, España.





Gracias por esta informacion tan valiosa sobre Covid 19
Soy Medica Acupuntora y tambien tratamos con esos criterios a los pacientes de Covit agudo y Covid Persistente